肝细胞癌(HCC)是全球癌症相关死亡的第二大原因,发病率在全球范围内不断上升,5年生存率低于20%。由于不同的疾病背景、肿瘤微环境和种族群体的多样性,HCC表现出明显的异质性特征。因此,阐明HCC的关键驱动因素,挖掘新的诊断和治疗靶点是当前HCC防治的重要策略。细胞代谢重编程是癌症的基本特征,为研究癌症诊断、预后、药物耐药性和治疗靶点提供了独特的视角。
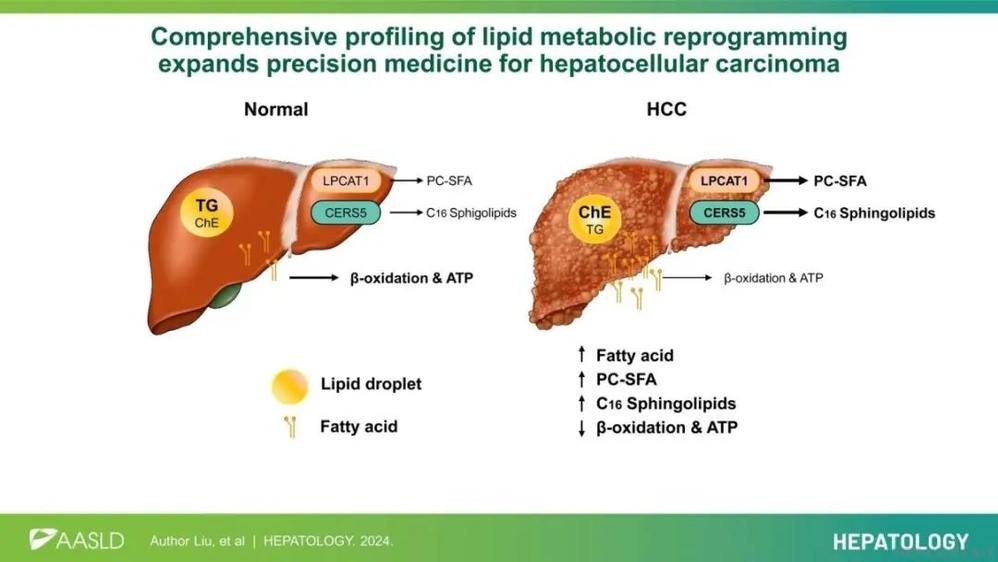
近期,蒋树龙课题组联合奥地利约翰开普勒大学虞甬团队在Hepatology杂志在线发表了题为 Comprehensive profiling of lipid metabolic reprogramming expands precision medicine for hepatocellular carcinoma 的研究论文。该研究揭示了HCC中甘油三脂(Triglyceride, TG)、磷脂酰胆碱(Phosphatidylcholine, PC)和鞘脂(Sphingolipids, SL)的代谢重编程特征,提出靶向饱和脂肪酸的磷脂酰胆碱(SFA-PC)和长链鞘脂生物合成途径,特别是通过抑制溶血磷脂酰胆碱酰基转移酶1(LPCAT1)和神经酰胺合酶5(CERS5),是HCC潜在治疗新策略。

研究人员通过转录组-代谢组分析48对肝癌和癌旁样本,解析了HCC异常代谢图谱,发现HCC样本中与葡萄糖流动、脂质氧化与降解以及新生脂质生成相关的代谢途径发生了显著改变,脂质组学结果显示甘油脂(TG)、磷脂酰胆碱(PC)和鞘脂(SL)衍生物存在异常变化。研究者进一步通过机器学习策略鉴定了一系列与脂质降解代谢相关的基因,这提示肝癌细胞中利用脂肪酸的能力下降或肝功能的受损。通过整合脂质组、转录组数据和TCGA数据库综合分析,明确了两个关键肿瘤驱动基因:鞘脂合成酶5(CERS5)和溶血磷脂酰胆碱酰基转移酶1(LPCAT1),二者重塑了HCC含饱和脂肪酸的磷脂酰胆碱(SFA-PC)和含有C16的长链鞘脂类生物合成途径。通过体内外模型,证实LPCAT1能够调控SFA-PC或MUFA的合成途径并改变细胞膜的流动性和生长通路,更为重要的是,CERS5能够驱动鞘脂介导的自噬/脂肪自噬促进肿瘤进展,而敲降CERS5或应用冬虫夏草提取物芬戈莫德(FTY720)靶向神经酰胺途径可显著抑制HCC,这为今后临床应用转化研究提供了重要参考。